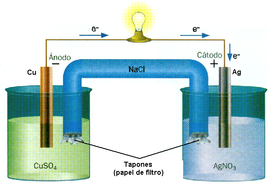
Reducción-oxidación

Trozo de metal oxidado (corroído)
Para que exista una reacción redox, en el sistema debe haber un elemento que ceda y otro que los acepte:
- El agente es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su es decir, siendo oxidado.
- El agente es el elemento químico que tiende a captar esos electrones, quedando con un inferior al que tenía, es decir, siendo reducidoCuando un elemento químico reductor cede electrones al medio se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un par redox. Análogamente, se dice que cuando un elemento químico capta electrones del medio se convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado.
- http://es.wikipedia.org/wiki/Reducci%C3%B3n-oxidaci%C3%B3n
No hay comentarios:
Publicar un comentario